Contents [非表示]
新しい抗ヒスタミン剤が承認された!
大鵬薬品の 第二世代ヒスタミンH1受容体拮抗薬
ビラノア錠20mg(一般名:ビラスチン)が
2016年9月9日の薬事・食品衛生審議会 医薬品第二部会にて
承認の可否が審議され無事に承認されました。
その後11月に発売になりました
ビラノア錠は2010年のザイザル以来の抗ヒスタミン剤
効能効果としては
アレルギー性鼻炎、蕁麻疹、皮膚疾患(湿疹・皮膚炎、皮膚そう痒症)に伴うそう痒となっており
通常、成人にはビラスチンとして1回20mgを1日1回空腹時に経口投与で申請になっています。
(適宜減量は削除になっているようです)
空腹時に服用ということで、食間?就寝前?それとも、起きたらすぐ(起床時)に飲むとか・・・?
ビラノア錠は食後に飲むと最高血中濃度(Cmax)は約60%
血中濃度-時間曲線下面積(AUC)は約40%低下してしまうようで、空腹時服用だそうです。
ようは効きが悪くなるってことです。

薬局としては調剤料が高い確率で取れる薬剤である反面
食後に飲めないというのはやはり痛いポイントだと思います
大きな特徴の1つが眠気が出にくい抗ヒスタミン剤
抗ヒスタミン剤ですが海外では車の運転に影響がないと言われているそうで
「抗ヒスタミン剤=眠くなる」という常識が覆るかもしれません。
添付文書にも運転に関する注意の記載はありません。
また、海外では12歳以上の季節性及び通年性アレルギー性鼻炎及び蕁麻疹を適応として取っているそうですが
日本では成人(15歳以上)のみの適応になっています。
少し前の数字になりますが、2015年5月の時点で世界90カ国以上の国・地域で承認されているそうです。
2016年5月では100以上の国・地域を超えたそうです。
花粉の時期の前に発売できるか?効果の強さと副作用の強さがどうか?今後要注目です。
→2016年11月18日に発売
アレグラ、アレロック、ザイザル、クラリチンに迫ることはできるのか!?
薬価はまだ不明ですが、ザイザルと同じぐらいになるのでは???と予想しています。
→ビラノア錠の薬価は79.70円と私が予想していた
ザイザル錠の96.40円とくらべて約2割安い薬価になっています。
気になる包装は?
包装は100T、420T、500Tと欲しい包装は網羅されています。
あえて言うなら140錠包装が欲しかった・・・
デザレックス錠は140錠包装あるんですよね~



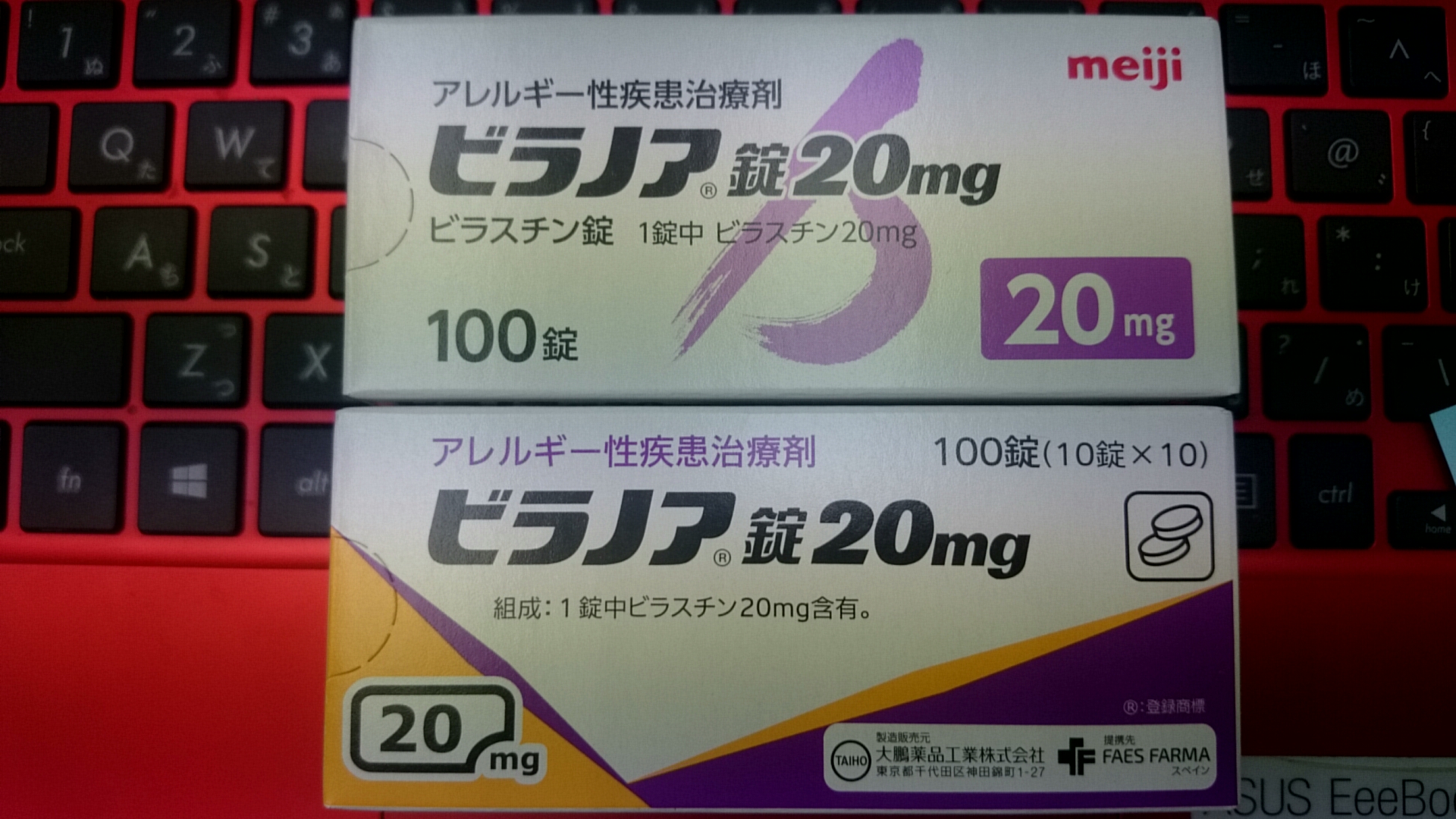
Meiji Seikaと大鵬薬品の併売で箱は違うけど中身は同じパターン
またMeiji Seikaファルマ株式会社と大鵬薬品の併売となります。
早速届いた箱です。上が明治で下が大鵬


残念ながら年が明けた3月でもまだ処方は出ない・・・
理由はただ1つ。
地域のMRの動きが悪かったこと・・・
動きが遅かった結果、発売近くにクリニックに行くと
どこも「MSDが来たからデザレックスを採用した」という感じだったそうです。

長期投与が可能になればもう少し処方が増えそうな予感です。
Meiji Seikaファルマ株式会社ホームページより引用
- ビラノアは非鎮静性の経口抗ヒスタミン薬です。1)、2)
- 1日1回投与で、アレルギー性鼻炎、蕁麻疹、皮膚疾患に伴うそう痒※に対して、速やかに効果を発現し、その効果は持続します。
- スギ花粉曝露で誘発した鼻症状を投与45分後から改善し、その効果は24時間持続しました。3)、4)
- 通年性アレルギー性鼻炎の鼻症状を投与1日目より改善しました。5)、6)
季節性および通年性アレルギー性鼻炎の鼻症状を投与1~3日目からベースラインに比べ有意に改善し、その効果は減弱することなく季節性は4週まで、通年性は52週まで持続が確認されました。7)、8) - 慢性蕁麻疹症状を投与1日目からプラセボと比較して有意に改善しました。9)、10)
慢性蕁麻疹および皮膚疾患に伴うそう痒※のいずれの症状も投与1~3日目からベースラインと比較して有意に改善し、その効果は減弱することなく52週まで持続が確認されました。11) - 薬物代謝をほとんど受けずに未変化体のまま尿中(28.3%)および糞中(66.5%)に排泄されます。12)
また、薬物代謝酵素(CYP)の阻害および誘導作用を有しません。(in vitro)13)、14)、15)、16) - 国内臨床試験において、675例中16例(2.4%)に副作用が報告されました。
主な副作用は、眠気4例(0.6%)、口渇および頭痛が各2例(0.3%)でした(承認時)。
1) Farré M, et al.: Br J Clin Pharmacol., 78(5), 970( 2014)
2) Farré M: Occupation of brain histamine H-1 receptors after administration of single doses of bilastine and hydroxyzine, evaluated by positron emission tomography (PET) with [11C]-doxepin. A randomised, double-blind, cross-over clinical trialin healthy volunteers, 社内資料, 研究報告書No.697(2016)
3) スギ花粉曝露室を用いたTAC-202の前期臨床第Ⅱ相試験,社内資料, 研究報告書No.640(2016)<承認時評価資料>
4) Hashiguchi K, et al.: Allergol Int., doi:10.1016/j.alit.2016.06.009(2016)
5) 通年性アレルギー性鼻炎患者を対象としたTAC-202の臨床第Ⅲ相試験,社内資料, 研究報告書No.641(2016)<承認時評価資料>
6) Okubo K, et al.: Allergol Int., doi:10.1016/j.alit.2016.05.014(2016)
7) 通年性及び季節性アレルギー性鼻炎患者を対象としたTAC-202の臨床第Ⅲ相長期投与試験,社内資料, 研究報告書No.642(2016)<承認時評価資料>
8) Okubo K, et al:. Auris Nasus Larynx, doi:10.1016/j.anl.2016.07.021(2016)
9) 慢性蕁麻疹患者を対象としたTAC-202の臨床第Ⅱ/Ⅲ相試験,社内資料, 研究報告書No.643(2016)<承認時評価資料>
10) Hide M, et al:. Allergol Int., doi:10.1016/j.alit.2016.08.004(2016)
11) 慢性蕁麻疹及び皮膚疾患に伴うそう痒患者を対象としたTAC-202の臨床第Ⅲ相長期投与試験,社内資料, 研究報告書No.644(2016)<承認時評価資料>
12) Diaz de Rada BS: Study on the Oral Bioavailability of Bilastine, 社内資料, 研究報告書No.596(2016)
13) Johanning K: In Vitro Assessment of Human Liver Cytochrome P450 Inhibition Potential of Bilastine,社内資料, 研究報告書No.586(2016)
14) Gedey S: In vitro Interaction Studies of One Selected Test Article with MRP2(ABCC2) and BSEP(ABCB11/sPgp)ABC(efflux) Transporters, and with OATP2B1(OATP-B) and OTC1 Uptake Transporters,社内資料, 研究報告書No.588(2016)
15) Bednarczyk D: Assessment of Bilastine as an inhibitor of human NTCP, BCRP, OAT1, OAT2, OCT2, OATP1B1, and OATP1B3 mediated transport,社内資料, 研究報告書No.589(2016)
16) Johanning K: In Vitro Assessment of Cytochrome P450 Induction Potential of Bilastine in Primary Human Hepatocytes,社内資料, 研究報告書No.587(2016)
※承認された効能・効果は次の通りです。
アレルギー性鼻炎、蕁麻疹、皮膚疾患(湿疹・皮膚炎、皮膚そう痒症)に伴うそう痒